
2020年11月9日,荣昌生物制药(烟台)有限公司(荣昌生物,股份代号:9995)于香港联合交易所有限公司(港交所)主板正式挂牌交易。

图1. 荣昌生物在港交所挂牌上市。
图片来源:荣昌生物
在计入额外期权之前,荣昌生物本次共发售约7.65千万股,每股作价52.10港元,发售所得总集资额约为39.9亿港元或5.15亿美元。截至目前为止,荣昌生物是本年度全球生物医药行业中规模最大的IPO。
荣昌生物是一家正在进入商业化阶段的生物制药公司,致力于开发同类首创(first-in-class)和同类最佳(best-in-class)的生物药。凭借三个主要技术平台——抗体及融合蛋白平台、抗体药物偶联物(ADC)平台、和双功能抗体平台,荣昌开发了超过十多种候选药物的完整管线。其中,泰它西普(RC18)、disitamab vedotin(RC48)、和RC28是其核心候选药物,分别用于治疗自身免疫疾病、癌症和眼科疾病。
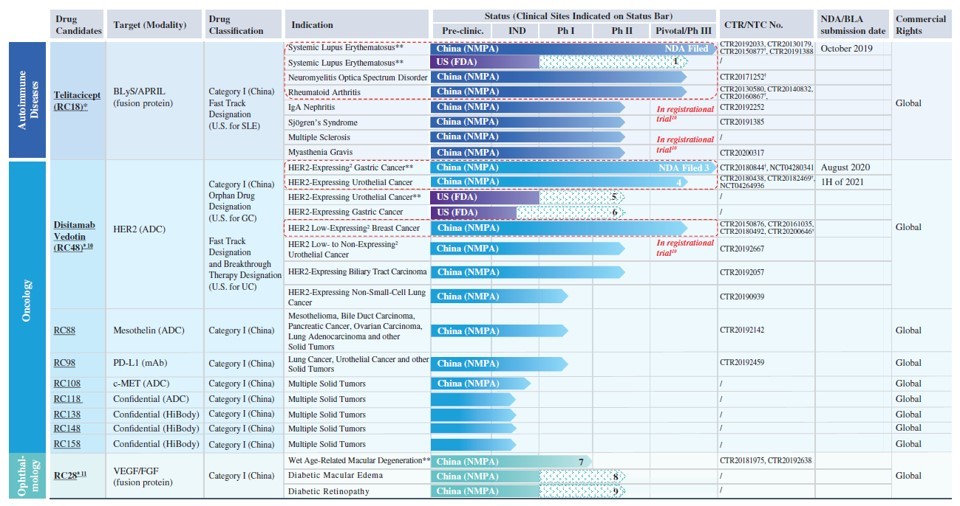
图2. 荣昌生物的药物管线。
图片来源:荣昌生物招股书
泰它西普(RC18)是一种同类首创、处于后期临床阶段的新型TACI-Fc融合蛋白,靶向与B细胞介导自身免疫性疾病有关的两个重要细胞信号分子BLyS及APRIL。系统性红斑狼疮(SLE)是泰它西普的主要适应症。荣昌最近在中国完成的IIb期注册性临床试验的结果已经证明泰它西普优异的临床疗效和良好的安全性,表明其在SLE领域具有成为同类最佳的潜力。在该试验中,多个剂量的泰它西普治疗组取得了70% - 79% 的第48周达到SLE应答指数4(SRI-4)应答的患者比例,显著高于安慰剂组32%的SRI-4应答率 。
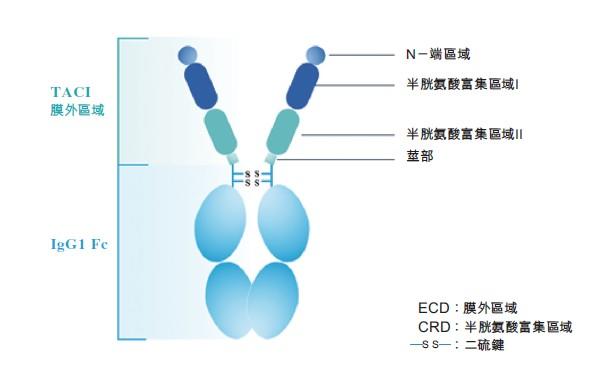
图3. 泰它西普(RC18)的分子结构。
图片来源:荣昌生物招股书。
中国药监局于2019年11月接受荣昌生物提交的有条件批准泰它西普用于治疗SLE的NDA,并于2019年12月授予其优先审评资格。批准将以在商业上市后对SLE完成验证性III期临床试验的承诺为条件,荣昌正在招募该项III期临床试验的患者。荣昌预期将于2020年第4季度(2020Q4)在中国取得上市批准并开始商业化活动。在美国,荣昌于2020年1月与FDA进行了II期临床结束会议,并获得FDA的同意,可以开展SLE的美国注册性临床试验。FDA于2020年4月授予泰它西普快速通道资格。荣昌预计将于2021年上半年启动全球III期临床试验。
Disitamab vedotin (RC48) 是处于后期临床阶段的抗HER2抗体-药物偶联物 (ADC),是在中国进入临床开发的首个自主开发ADC药物。在中国,荣昌已完成了Disitamab vedotin针对HER2高表达的胃癌的注册性临床试验,并正开展针对HER2高表达的尿路上皮癌和HER2低表达的乳腺癌两个适应症的注册性临床试验。中国药监局已接受荣昌生物提交的有条件批准Disitamab vedotin用于治疗胃癌的NDA,并于2020年8月授予其优先审评资格。在美国,FDA已授予RC48在胃癌上的孤儿药资格认定,并批准了该药在美国进行II期临床试验的IND申请。
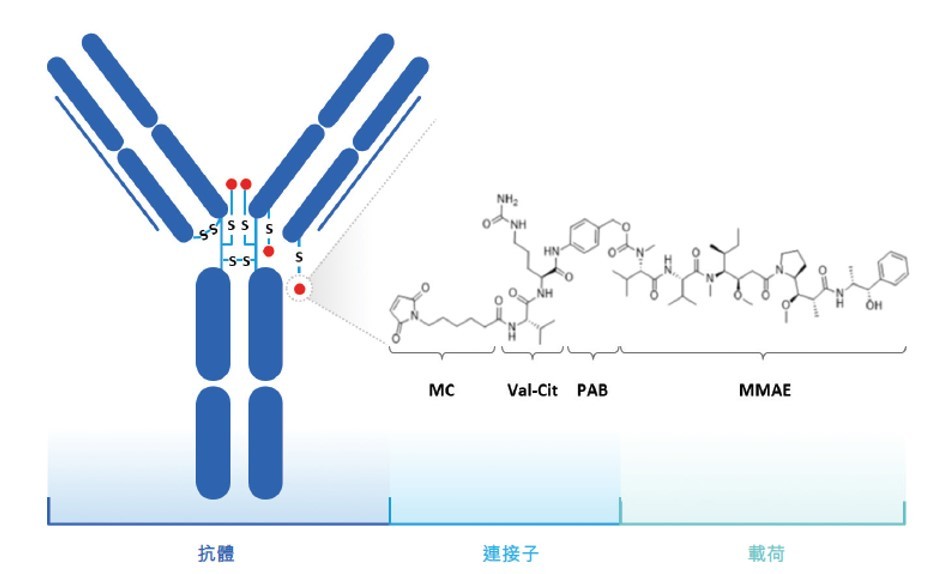
图4. Disitamab vedotin (RC48) 的分子结构。
图片来源:荣昌生物招股书。
RC28是用于治疗眼部疾病的潜在同类首创VEGF/FGF双靶点融合蛋白。与单靶点VEGF抑制剂相比,RC28通过VEGF及FGF双通道在原理上会更有效地抑制与多种眼部疾病有关的非正常血管增生,并有可能允许更优的给药方案。RC28在湿性老年性黄斑病变(湿性AMD)患者的中国I期剂量递增临床研究中,表现出良好的安全性。荣昌已启动湿性AMD的Ib期临床研究,并计划于2020Q4或2021Q1在中国启动糖尿病黃斑水肿 (DME) 及糖尿病视网膜病变 (DR) 的II期临床研究。
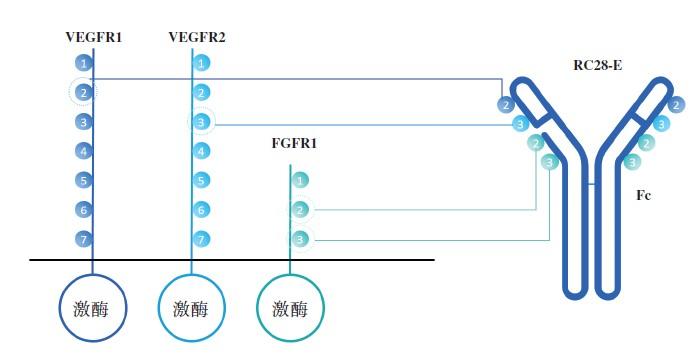
图5. RC28是一个重组双诱饵受体 – IgG1 Fc融合蛋白,同时针对VEGF和FGF家族。
图片来源:荣昌生物招股书。
礼来亚洲基金 (LAV) 领投了荣昌生物在今年3月份完成的超过1亿美元融资,并作为基石投资者参与了IPO。
11月9日是荣昌生物在港交所交易的第一天。截至香港时间上午11点,荣昌生物的股价已上升至69.30港元,涨幅达33%。
参考资料:
1. 荣昌生物招股书 https://www1.hkexnews.hk/listedco/listconews/sehk/2020/1028/2020102800023.pdf 2. RemeGen Readies $514M IPO as HKEX Adds Jewel to the Crown, Amber Tong, Endpoint News, 10/28/2020