
2019年3月28日, 康希诺生物股份公司(康希诺生物,股份代号:6185),今天于香港联合交易所有限公司(港交所)主板正式挂牌交易。公司董事长兼CEO宇学峰博士及股东代表礼来亚洲基金合伙人林亮先生在港交所交易大厅共同敲响开市铜锣。

康希诺生物发售5724.86万股H股,其中572.52万股在香港发售,其余5152.34万股将作国际发售,每股作价22港元,发售所得总集资额为12.59亿港元。
到香港时间下午4点收盘时, 康希诺股票价格已从IPO价格22港元上升至34.70港元,首日涨幅57.7%。
作为港股第一疫苗股的康希诺生物,肩负着研发、生产和商业化高质量、创新及经济实惠疫苗的使命,为中国和全球公共卫生健康安全提供更安全、高效的疫苗产品,同时为投资者创造价值。在过去近10年时间里,康希诺致力于创新疫苗关键技术和产品研发。未来,康希诺将加速促进研疫苗产品的商业化,重点关注中国和国际新兴市场对高质量疫苗不断扩大的需求。
自2013年成为股东以来,礼来亚洲基金与康希诺在战略发展及数次融资中携手并进,并将会继续支持公司发展为世界一线的疫苗企业。
康希诺的核心竞争优势包括以下几点:
庞大且尚未满足的中国市场
中国是全球最大的人用疫苗潜在需求市场,2017年中国人均疫苗支出仅为2.9美元,不足美国的6%。中国内地人用疫苗市场未来在规模和疫苗产品质量上存在巨大发展空间。中国人用疫苗市场规模预计将在2030年达到人民币1009亿元,2017年至2030年复合年增长率为11.2%,其中私人疫苗市场从2017年到2030年复合年增长率为12.3%, 私人市场占比达到90%以上。康希诺生物全面且强大的疫苗产品线旨在针对中国庞大却供不应求的市场。
康希诺生物已经开始构建商业化架构,主要专注于中国的私人疫苗市场。预计五个主要因素将驱动中国疫苗市场发展:越来越多的高质量疫苗, 随着人口老龄化出现尚未开发的成人市场,疫苗接种优势意识的提升,私人疫苗市场的可负担性提高,政府支出增加和预防性医疗保健的政策支持。在此进程中,拥有核心技术、创新产品管线和国际视野的企业将获得更大竞争优势。
拥有丰富跨国疫苗行业经验的高管团队
公司创始人和管理运营团队均是疫苗行业的资深人士,包括多位曾就职于赛诺菲巴斯德、阿斯利康和惠氏(现为辉瑞)等国际知名药企,负责创新疫苗研究的世界顶尖科学家,对全球疫苗研发趋势和商业化运营具有丰富经验。其他管理运营成员都来自跨国或国内领先生物制药企业,在疫苗产品注册、质量管理和疫苗营销管理等方面,均是行业中的资深专家。
多样化的创新疫苗产品线
康希诺生物拥有覆盖12个疾病领域研发的15种在研疫苗及3项临近商业化的疫苗。康希诺生物在研的MCV4为准备提交新药申请且有望成为中国预防脑膜炎的首创疫苗,凭借质量更高的世界级疫苗取代现时的多糖疫苗;而康希诺生物在研的MCV2已提交新药申请且有望成为中国潜在最佳双价脑膜炎球菌疫苗。MCV4及MCV2疫苗均于三期临床结果显示出更好的安全性及免疫原性。
此外,公司的全球创新疫苗Ad5-EBOV是中国第一种获批准的埃博拉病毒疫苗,并获批准作应急使用及国家储备。与跨国企业的竞争产品相比,康希诺生物的Ad5-EBOV展示出更佳的稳定性且不需要超低温储存条件。
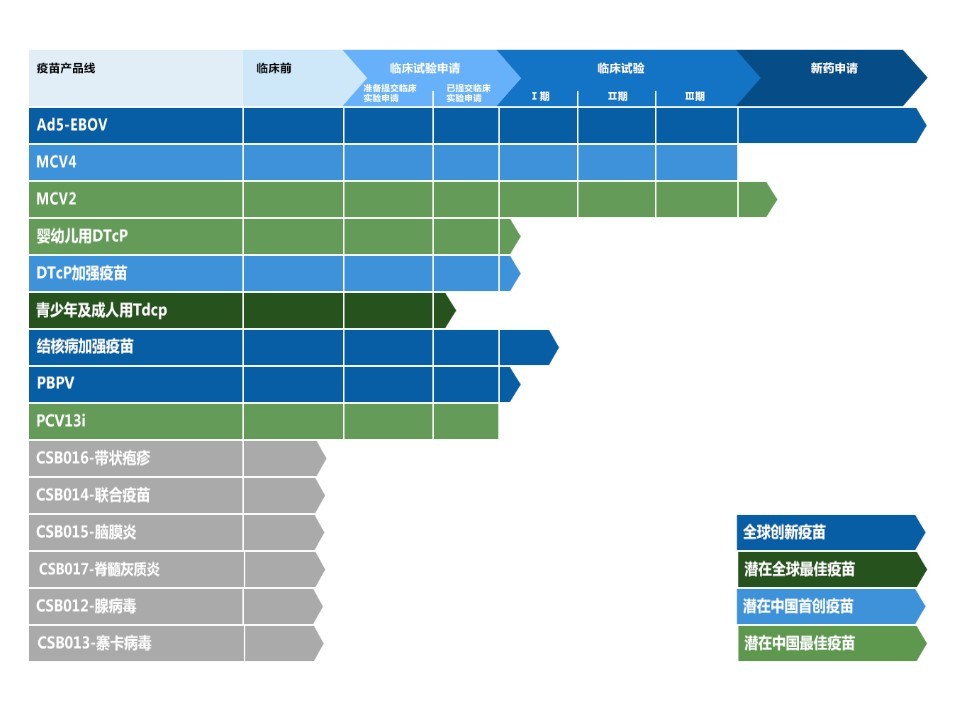
图:康希诺生物的疫苗管线。(来源:康希诺官网)
除了3项临近商业化疫苗产品,公司有6种在研疫苗处于临床试验阶段或临床试验申请阶段,及6种临床前在研疫苗。中国百白破疫苗市场预计将于未来十年快速扩大,其销售收入将由2017年的19亿元人民币增至2030年的82亿元人民币,年均复合增长率为12.2%。公司正致力研发1种潜在的中国最佳婴幼儿用DTcP疫苗,凭借质量更高的世界级疫苗取代现时的主流疫苗。与现时在中国广泛使用的共纯化DTaP疫苗相比,康希诺生物的婴幼儿用在研DTcP具有固定且定义明确的DTcP抗原组合物,并拥有更好且更一致的免疫原性。同时,公司亦正研发一种潜在的中国首创DTcP加强疫苗,以替换中国目前使用的DT疫苗。此外,公司正研发的青少年及成人用在研Tdcp是一种潜在的全球最佳疫苗。目前,中国尚未有已批准之用于青少年和成人的DTP加强疫苗。
同时,中国的肺炎球菌疫苗市场为私人疫苗市场,预计于2017年至2030年间将按年均复合增长率18.8%增加至2030年的142亿元人民币。康希诺生物正在研发两种预防肺炎球菌疾病的潜在重磅疫苗,即中国潜在最佳PCV13i疫苗和全球创新疫苗PBPV,以及一种全球创新的结核病加强疫苗。
先进的疫苗研发平台技术
技术是保证公司持续创新能力的基础。康希诺生物的创始人在疫苗研发方面累积的丰富经验和技术知识,为康希诺生物建立了基于腺病毒载体疫苗技术、结合技术、蛋白结构计和重组技术、制剂技术这四大平台技术的疫苗发展作出了莫大贡献。各平台技术之间相辅相成,为公司的研发工作制造协同效应,令公司能够以具有成本效益的方式研发疫苗及构建一个全面的疫苗产品组合。这些平台技术保证公司具备持续创新能力,并在未来市场竞争中,获得更多比较优势。
国际标准的生产厂房及质量管理体系
康希诺生物拥有并运营一处具有商业规模的生产基地,总建筑面积约37,000平方米,其设计、建造及运营均符合国际标准。该厂房的年原液产能约为7,000万至8,000万剂,该厂房在将充分支持临近商业化在研疫苗的商业化计划以及临床试验材料的生产。此外,公司自疫苗研发至生产实施了一整套的综合质量管理。康希诺生物的研发设施按照世界标准进行设计。位于公司研发中心内的GMP中试车间已通过EMA的QP检查。
参考资料:
1. www.cansinotech.com.cn 康希诺官网
2. 康希诺生物招股书
注:斜字部分来自康希诺生物的新闻发布。