
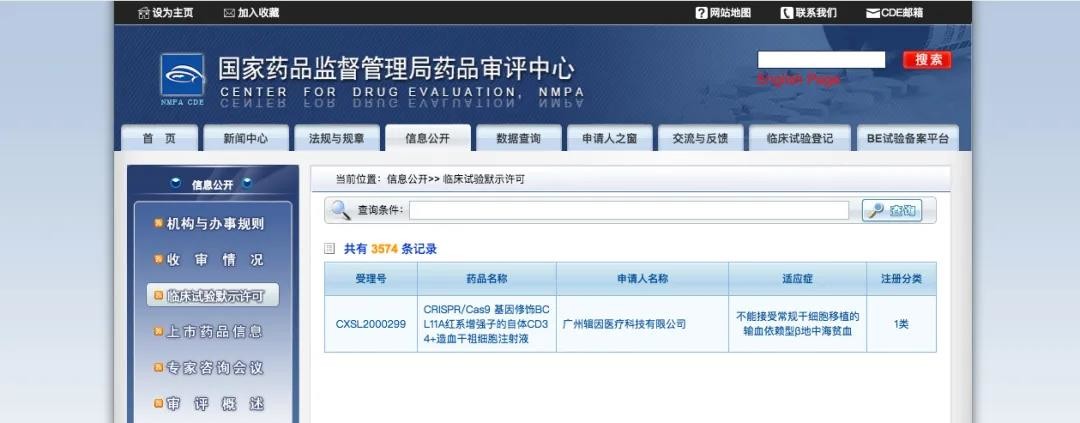
中国北京和美国马萨诸塞州剑桥,2021年1月18日,博雅辑因今日宣布中国国家药品监督管理局药品审评中心已经批准其针对输血依赖型β地中海贫血的CRISPR/Cas9基因编辑疗法产品ET-01的临床试验申请,这也是国内首个获国家药监局批准开展临床试验的基因编辑疗法产品和造血干细胞产品。博雅辑因是一家以基因组编辑技术为基础,针对多种疾病加速药物研究并开发创新疗法的生物医药企业。此前,博雅辑因曾于2020年10月27日宣布药监局正式受理其针对ET-01的临床试验申请。
“我们非常高兴ET-01临床试验申请获得了国家药监局的许可,I期临床试验会尽快开展。”博雅辑因首席执行官魏东博士表示,“这也标志着公司的发展正式进入了临床阶段。我们将继续致力于高质量转化基因编辑技术,持续推进公司其他产品管线的研发进程,为中国乃至全球的患者带来更多新的治疗选择。”
ET-01是一款处于研发阶段的、自体的、体外基因编辑疗法产品,此次获批开展的临床试验是一项多中心、开放的、单臂临床研究,该项研究将在输血依赖型β地中海贫血患者中评价ET-01单次移植的安全性和有效性。在中国,中重型地中海贫血病患者达30万人,输血依赖型β地中海贫血患者仍有巨大的未被满足的医疗需求。
关于ET-01
ET-01的通用名为CRISPR/Cas9基因修饰BCL11A红系增强子的自体CD34+造血干祖细胞注射液,是处于研发阶段的、自体的、体外基因编辑细胞疗法产品,用于治疗输血依赖型β地中海贫血。ET-01原液通过采集患者自体动员外周血单个核细胞,富集CD34+细胞群后用CRISPR/Cas9系统编辑BCL11A基因的红系增强子制成。
关于地中海贫血
地中海贫血是指一组由珠蛋白基因缺失或点突变致使珠蛋白肽链合成被部分或完全抑制的遗传性溶血性贫血疾病。根据珠蛋白肽链合成障碍的种类不同,一般将地中海贫血病分为α地中海贫血、β地中海贫血、γ地中海贫血、δ地中海贫血、δβ地中海贫血和εγδβ地中海贫血。临床上,最常见的为α地中海贫血和β地中海贫血,由组成正常成年人的血红蛋白(HbA, α2β2)的两种多肽链(α或β)之一减少所致。
同时,按照国际地贫协会的分类及临床特征,地中海贫血可分为输血依赖型地贫(transfusion- dependent thalassemia,TDT)和非输血依赖型地贫(non-transfusion-dependent thalassemia,NTDT),输血依赖型地贫患者需要终身依赖输血才能维持生命,如不予输血,将发生严重并发症和早期死亡[1]。
关于博雅辑因
博雅辑因(EdiGene, Inc.)是一家处于临床阶段的,致力于通过国际前沿的基因组编辑技术,为多种遗传疾病和癌症加速药物研究以及开发创新疗法的生物医药企业。博雅辑因已经建立了拥有自主知识产权的针对造血干细胞和T细胞的体外细胞基因编辑治疗平台,基于RNA单碱基编辑技术的体内基因治疗平台和致力于靶向药物研发的高通量基因组编辑筛选平台。博雅辑因创立于2015年,总部位于北京,在广州以及美国剑桥设有分公司。如需了解更多信息,敬请访问公司官网:www.edigene.com
参考文献:
[1] Guidelines for theManagement of Transfusion Dependent Thalassaemia(TDT) 3rd Edition: ThalassaemiaInternational Federation(TIF); 2014.
新闻来源:博雅辑因